

| 1. |  |
2. |  |
| Versuchsaufbau | Rauch aus Ammoniumchlorid |
| 1. Ammoniak-Darstellung: | In einem 250ml Zweihalskolben werden Natriumhydroxid-Perlen vorgelegt.
Aus einem Tropftrichter mit Druckausgleich wird eine gesättigte Ammoniumchlorid-Lösung vorsichtig zugetropft. Es bildet sich Ammoniak nach NH4Cl + NaOH > NH3 + NaCl + H2O
|
| 2. Nachweis als Ammoniumchlorid: | Das entstehendene Ammoniak-Gas wird in ein Becherglas geleitet, das mit etwas Salzsäure gefüllt ist. Es bilden sich weiße Nebel von Ammoniumchlorid (Salmiak) nach NH3 + HCl > NH4Cl
Der vorliegende Versuchsaufbau stellt ein gebräuchliches Verfahren zur Ammoniak-Darstellung im Labor dar. Großtechnisch wird Ammoniak jedoch nach dem Haber-Bosch-Verfahren aus den Elementen hergestellt:3 H2 + N2 > 2 NH3
Bei dieser exothermen (Reaktionsenthalpie - 92.28 kJ/mol) und unter Volumenverminderung verlaufenden Reaktion verschiebt sich das Gleichgewicht mit fallender Temperatur und steigendem Druck auf die rechte Seite, d.h. optimaler NH3-Umsatz wird theoretisch bei niedriger Temperatur und hohen Drucken realisiert. Bei Raumtemperatur ist die Geschwindigkeit der Umsetzung jedoch unmeßbar klein.
Gebräuchliche Katalysatoren haben erst oberhalb von 400°C einen Effekt. Bei dieser Temperatur und Atmosphärendruck liegt die Ausbeute an Ammoniak jedoch nur im Bereich von 1 %, was wirtschaftlich nicht tragbar ist. Aus diesem Grund arbeitet man zusätzlich bei erhöhtem Druck, etwa 150-250 . 105 Pa. Auf diese Weise erhält man Ausbeuten im Bereich von 15 %.
|
| Aufgabe 4.4.22.1: Lösung |
Berechnen Sie mit dem Satz von Hess die Bildungsenthalpie für die Bildung von Ammoniumchlorid gemäß
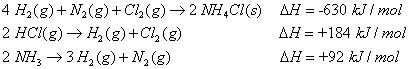 |
| Aufgabe 4.4.22.2: Lösung |
Bei Einsatz einer stöchiometrischen Mischung von N2 ung H2 finden sich im Gleichgewicht bei 200 bar und 470 °C 20 Vol-% Ammoniak. Berechnen Sie daraus den Zahlenwert der Gleichgewichtskonstanten unter diesen Bedingungen. |