

| 1. |  |
2. |  |
| Wasserstoff-Lampe | Spektrum der Wasserstofflampe |
| 1. Bild: | Das Foto zeigt eine Wasserstofflampe. In dieser werden Wasserstoffmoleküle durch einen Elektronenstrahl in angeregte Wasserstoffatome zerlegt, die dann ihre Anregungsenergie in Form von elektromagnetischer Strahlung abgeben. Ein Teil dieser elektromagnetischen Strahlung liegt im sichtbaren Bereich des Lichts. |
| 2. Bild: | Die Wasserstofflampe liefert, im Gegensatz zu der in 2.7.1 gezeigte Wolframlampe, kein kontinuierliches Spektrum, sondern diskrete Linien. Vier dieser Linien befinden sich im sichtbaren Bereich des Spektrums, der Rest liegt im ultravioletten und im infraroten Bereich. Von den 4 sichtbaren Linien erscheint die rote am hellsten, weshalb die Wasserstofflampe auch rot erscheint. |
| Aufgabe 2.7.1.3: Lösung |
Bohr fand einen Ausdruck, der die Rydberg-Konstante oder -Frequenz durch Naturkonstanten ausdrückt: RH=(me×e4 / 8x3 ×
e02)
e=Elementarladung, 1.602×10-19 Cmit: e 0 = Dielektrizitätskonstante im Vakuum, 8.85 × 10-12 C2/(J m) me=Masse des Elektrons, 9.11×10-31 kg Welche Einheit hat der Faktor x? Um welche Naturkonstante handelt es sich?
|
| Aufgabe 2.7.1.4: Lösung |
Die Rydberg-Konstante läßt sich auch durch folgenden Ausdruck darstellen:
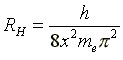 Welchen Wert und welche Einheit hat der Faktor x. Um welchen Wert handelt es sich? |
| Aufgabe 2.7.1.5: Lösung |
Welche Wellenlänge hat ein Photon, daß beim Übergang zwischen den beiden Zuständen n1=2 und n2=4 emittiert wird? |