


| 1. |  |
2. |  |
3. |  |
| 4. |  |
5. |  |
6. |  |
| 7. |  |
8. |  |
9. |  |
| 1.Bild: | Ein Reagensglas, das mit einem Gemisch aus Chlor und Methan gefüllt ist, wird vor einer Blitzlampe (weißes Licht) positioniert. |
| 2.Bild: | Die Blitzlampe wird gezündet, das Reagensglas explodiert mit einem lauten Knall. |
| 3.Bild: | Nach dem Lichtblitz ist das Reagensglas tatsächlich verschwunden. Chlor-Moleküle werden durch weißes Licht in Chlor-Radikale gespalten und lösen in Kombination mit Methan eine stark exotherme Kettenreaktion aus. Im Detail laufen folgende Reaktionen dabei ab: a) Elementares Chlor absorbiert Licht, wodurch ein Teil der Chlormoleküle in Chlorradikale dissoziiert (Startreaktion):
Cl2 b) Die entstandenen Chlorradikale reagieren mit Methan zu Methylradikalen und Salzsäure (Kettenfortpflanzung):
Cl . + CH4 > HCl + CH3. Die Methylradikale reagieren wiederum mit Chlormolekülen in einer stark exothermen Reaktion unter Bildung von Methylchlorid und Chlorradikalen: CH3. + Cl2 > CH3Cl + Cl . Die unter b) genannten Prozesse stellen die Chemiker gerne in einem Cyclus dar. Da pro gespaltenem Chlormolekül der Cyclus unter Bildung von Methylchlorid und Salzsäure im Durchschnitt 5000 mal abläuft, wird in dieser Radikalkettenreaktion sehr schnell eine große Menge an Energie freigesetzt (Explosion):
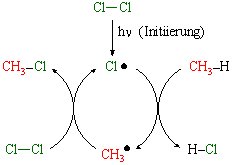 Beendet wird die Radikalkettenreaktion durch eine Rekombination von Radikalen:
CH3. + CH3. > C2H6
Cl . + Cl . > Cl2
CH3. + Cl . > CH3Cl Diesen Effekt machte man sich bei den (wegen ihrer ozonschädigenden Wirkung inzwischen verbotenen) Halon-Löschmitteln zunutze. Diese bestehen aus halogenierten Kohlenwasserstoffen, die in der Flamme in Radikale zerfallen, die dann ihrerseits als Radikalfänger in die Kettenreaktion der Verbrennung eingreifen. Weißes Licht ist eine Kombination aus allen Wellenlängen des sichtbaren Lichts. Um zu verstehen, welche Energie das Licht haben muß, damit es für die Spaltung der Chlormoleküle ausreicht, werden im Folgenden Photolyseversuche mit rotem (energiearm) und blauem (energiereich) Licht durchgeführt: |
| 4.Bild: | Der Versuch wird wiederholt, allerdings wird diesmal ein Farbfilter benutzt, der nur rotes Licht hindurchläßt. |
| 5.Bild: | Die Blitzlampe wird gezündet, es kommt zu keiner Reaktion. |
| 6.Bild: | Das Reagensglas ist weiterhin vorhanden. Rotes Licht ist nicht energiereich genug, um Chlor-Moleküle in Radikale zu spalten. Es kommt zu keiner Reaktion. |
| 7.Bild: | Das Reagensglas aus dem vorigen Versuch wird erneut vor einer Blitzlichtlampe positioniert. Vor der Blitzlampe befindet sich nun ein Farbfilter, der nur blaues Licht hindurchläßt. |
| 8.Bild: | Die Blitzlampe wird gezündet, das Reagensglas explodiert mit einem lauten Knall |
| 9.Bild: | Obwohl das blaue Licht nur einen Teil des weißen Lichts darstellt, reicht seine Energie für die Spaltung von Chlormolekülen aus, was zur oben beschriebenen Kettenreaktion führt. |
| Aufgabe OC 1.2.1: Lösung |
Die Cl-Cl-Bindung hat eine Bindungsenergie von 242 kJ/mol. Berechnen Sie, welche Wellenlänge das eingesetzte Licht haben muß, um die Bindung zu spalten. |