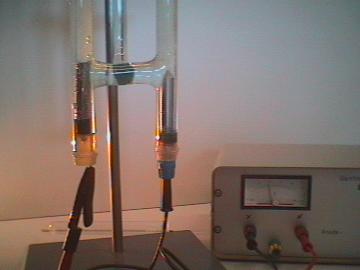



1. |
2. |
| Arreglo experimental | El Hidrógeno se detecta usando una prueba de tablilla encendida. |
3. |
4. |
| Probar la existencia de oxígeno usando una prueba de tablilla brillante. | El Oxígeno se detecta usando la prueba de tablilla brillante. |
| Foto 1: | El agua se descompone en los elementos Hidrógeno y Oxígeno utilizando el aparato de Hoffman’s para electrólisis. El agua se colorea azul claro usando el tinte azul nilo. Además, para incrementar la conductividad, se añade ácido sulfúrico (electrolito). El agua pura no conduce la electricidad. |
| Foto 2: | Podemos detectar el Hidrógeno usando una prueba llamada “tablilla encendida” (detonación de gas), en la cual una flama se mantiene cerca de la entrada del tubo que contiene el Hidrógeno. Si el Hidrógeno está presente, el gas se enciende. |
| Foto 3: |
Podemos comprobar la existencia de Oxígeno utilizando la prueba llamada “tablilla brillante”. La tablilla brillante se mantiene cerca del tubo que contiene el oxígeno. Si el Oxígeno está presente, la tablilla se enciende nuevamente. |
| Foto 4: |
Cuando la válvula es abierta, la tablilla brillante se enciende y encandece, indicando que el Oxígeno está de hecho presente. El principio básico de la electrólisis es que la aplicación de una corriente eléctrica puede obligar a una reacción tomar lugar en la dirección opuesta a la cual ocurriría espontáneamente. La descomposición del agua en sus elementos constituyentes básicos demostrados aquí es la inversa de la reacción (espontánea) del Hidrógeno y Oxígeno para formar agua. Las siguientes 2 reacciones toman lugar en los polos: Cátodo: 2 H2O + 2 e- > H2 + 2 OH- |