



| 1. |  |
2. |  |
| Eingesetzte Chemikalien; Schwefel und Eisenspäne | Erhitzen des Gemisches | ||
| 3. |  |
4. |  |
| Beginnende Reaktion | Aufsteigende Schwefel-Dämpfe | ||
| 5. |  |
6. |  |
| Die Schwefel-Dämpfe entzünden sich | Das Reaktionsprodukt ist nicht magnetisch |
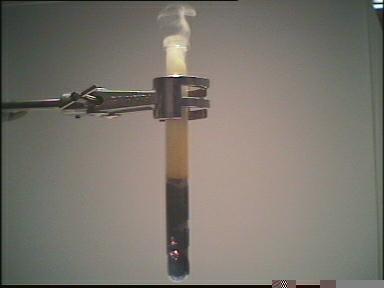
| 1.Bild: | In einem Reagensglas werden 5 g Eisenspäne und 5 g Schwefel gemischt. |
| 2.Bild: | Das Reaktionsgemisch wird mit einem Bunsenbrenner erhitzt. |
| 3.Bild: | Kurze Zeit, nach dem der Schwefel aufgeschmolzen ist, beginnt die Reaktion. Eisen reagiert mit Schwefel in einer einfachen, exothermen Reaktion zu Eisensulfid:
Fe + S ® FeS |
| 4.Bild: | Durch die entstehende Wärme verdampft der Schwefel. |
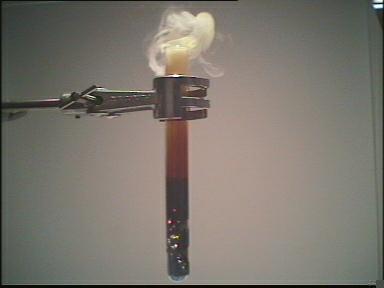
| 5.Bild: | Schließlich entzündet sich der Schwefel-Dampf und verbrennt mit hellblauer Flamme. |
| 6.Bild: | Der entstehende Rückstand ist nicht magnetisch. Eisensulfid reagiert mit Salzsäure zu Schwefelwasserstoff und Eisenchlorid:
FeS + 2 HCl® FeCl2 + H2S Da das Internet jedoch noch nicht in der Lage ist, Gerüche wiederzugeben, haben wir auf die Durchführung dieses Versuches verzichtet. |