

| 1. |  |
2. |  |
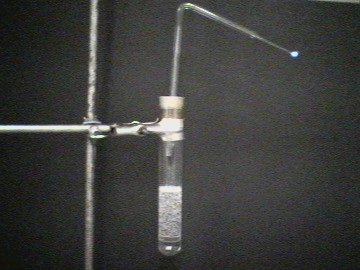
| Arreglo experimental | Burbujas de Monóxido de Carbono elevándose |
||
| 3. |  |
4. |  |
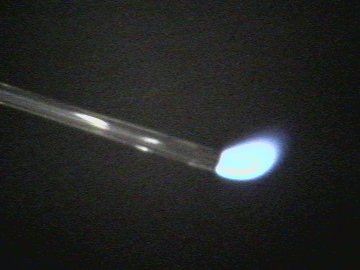
| El Monóxido de Carbono arde con una llama ligeramente azul |
Acercamiento a la flama |
| Foto 1: | Arreglo experimental: 20 mL de Ácido Sulfúrico concentrado y 40 mL de Ácido Fórmico son colocados en un tubo de ensaye. Se coloca en el tubo de ensaye un tapón de caucho agujerado, el cual contiene un tubo de vidrio doblado. |
| Foto 2: | El Ácido Sulfúrico concentrado deshidrata el Ácido Fórmico. Se produce Monóxido de Carbono: (H2SO4)
HCOOH
>
CO + H2O |
| Foto 3, 4: | El Monóxido de Carbono es combustible y arde con el aire con una llama azulosa, convirtiéndose en Dióxido de Carbono Este es un procedimiento estándar para producir Monóxido de Carbono en el laboratorio. |
| Precauciones de seguridad; | El Monóxido de Carbono es un gas altamente venenoso. Su afinidad a la Hemoglobina en la sangre es aproximadamente 300 veces mayor que la del Oxígeno. Por esta razón, remplaza al Oxígeno en la O2-Hemoglobina, e interrumpe su función como transportador de Oxígeno. Esto provoca un paro respiratorio a nivel celular, el cual conduce a la muerte. El peligro particular de un envenenamiento por CO se debe al hecho de que una persona envenenada no puede ser salvada simplemente por colocarla en un ambiente libre de Monóxido de Carbono y rico en Oxígeno, ya que la Hemoglobina continúa bloqueada. Primero se debe dar respiración artificial con Oxígeno puro sobrepresurizado para así poder regresar la Hemoglobina a su función original y con ello la respiración celular. |