

| 1. |  |
2. |  |
| Dispositif expérimental | Formation des bulbes de monoxyde de carbone | ||
| 3. |  |
4. |  |
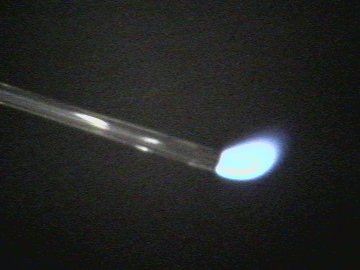
| Le monoxyde de carbone brûle d´une flamme vive et bleue | Plan rapproché de flamme |
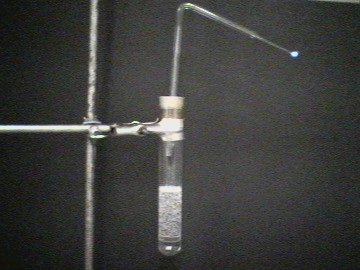
| Photo 1: | Dispositif expérimental: 20 ml d´acide sulfurique concentré et 40 ml d´acide formique sont placés dans un tube à essai. Il est fermé par un bouchon en caoutchouc perforé prolongé d´un tube en verre coudé |
| Photo 2: | L´acide sulfurique concentré déshydrate l´acide formique. Le monoxyde de carbone est formé: (H2SO4) HCOOH > CO + H2O |
| Photo 3, 4: | Le monoxyde de carbone est combustible et brûle dans l air d´une flamme bleuâtre en se transformant en dioxyde de carbone. Cette méthode est un procédé standard de préparation du monoxyde de carbone en laboratoire . |
| Mesure de sécurité | Le monoxyde de carbone est un gaz empoisonnant. Son affinité avec l´hémoglobine sanguin est approximativement 300 fois supérieures à celle de l´oxygène. Pour cette raison, il peut remplacer l´oxygène sanguin, et perturber sa fonction. Ceci entraîne l´arrêt de la respiration cellulaire, provoquant la mort. Le danger particulier d´un empoisonnement au CO est que la victime ne peut pas être sauvé juste par déplacement dans un endroit riche en oxygène ou pauvre en CO, car l´hémoglobine reste bloqué. Tout d´abord la respiration artificielle à l´oxygène pure sous haute pression doit être pratiqué afin de ramener l´hémoglobine à sa fonction première et ainsi entraîner la reprise de la respiration cellulaire. |